13 Aufbau und Eigenschaften der Stoffe
13.1 Eigenschaften und Aufbau der Stoffe (Seite 151 lesen)
13.2 Zusammensetzung organischer Stoffe (Seite 151 lesen)
13.3 Konstitution organischer Stoffe
13.3.1 Bindungsarten
Die hauptsächliche Bindungsart in organischen Verbindungen ist die kovalente Bindung, da organische Verbindungen vor allem aus Nichtmetallen zusammengesetzt sind. Organische Verbindungen zersetzen sich bei höheren Temperaturen. Der immer anwesende Kohlenstoff führt bei Zersetzungsreaktionen oft zur Bildung von schwarzen kohlenstoffhaltigen Resten ("Verkohlung").
Beispiel
Das Erhitzen von Zucker führt nach anfänglichem Schmelzvorgang zur allmählichen Zersetzung. Kochsalz hingegen schmilzt lediglich ohne sich zu zersetzen.
Die ionische Bindung gibt es in organischen Verbindungen vor allem bei Salzen von Säuren und Säureresten. Ionische Vernindungen sind aus Kationen und Anionen aufgebaut.
Beispiel
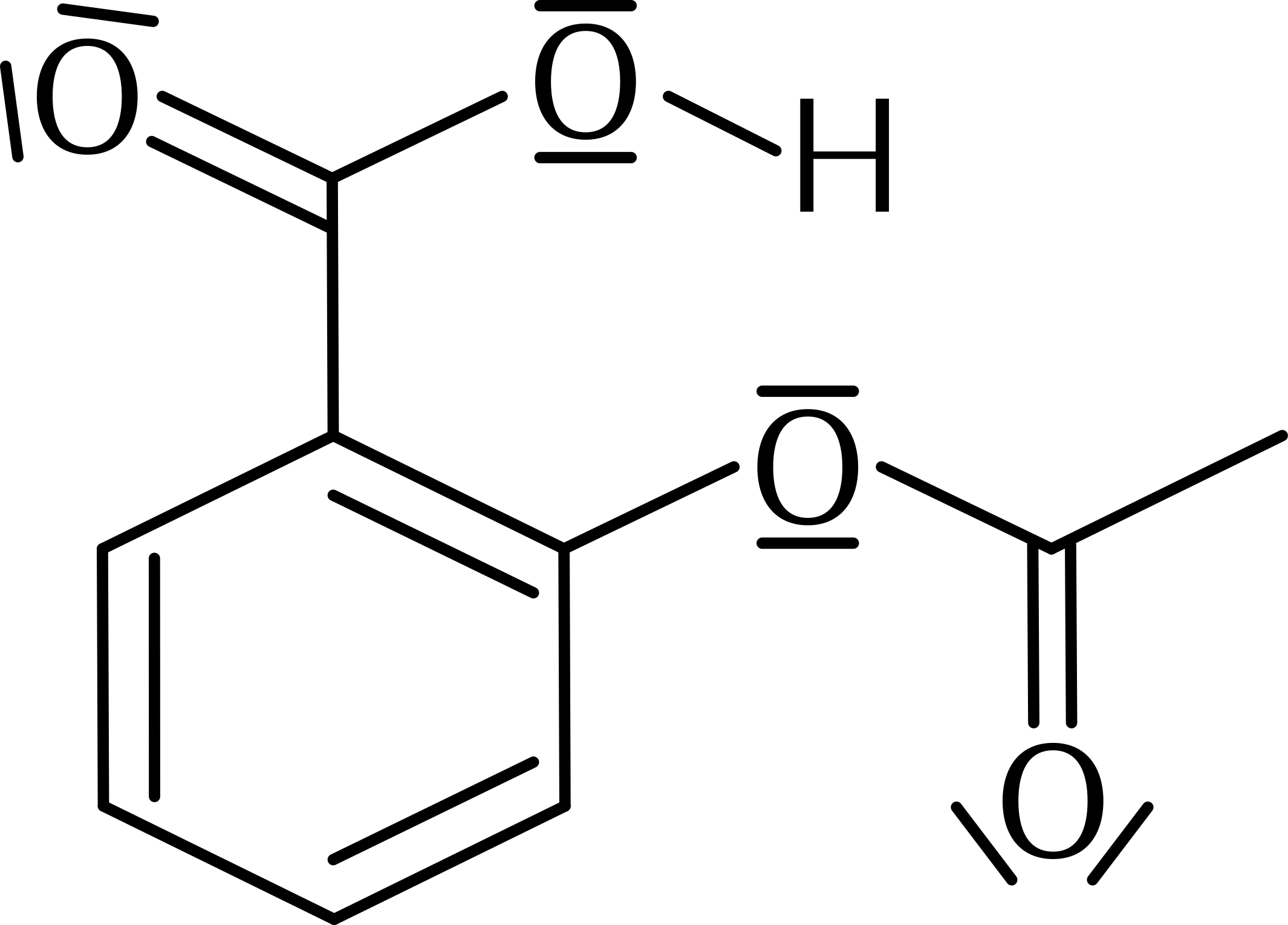
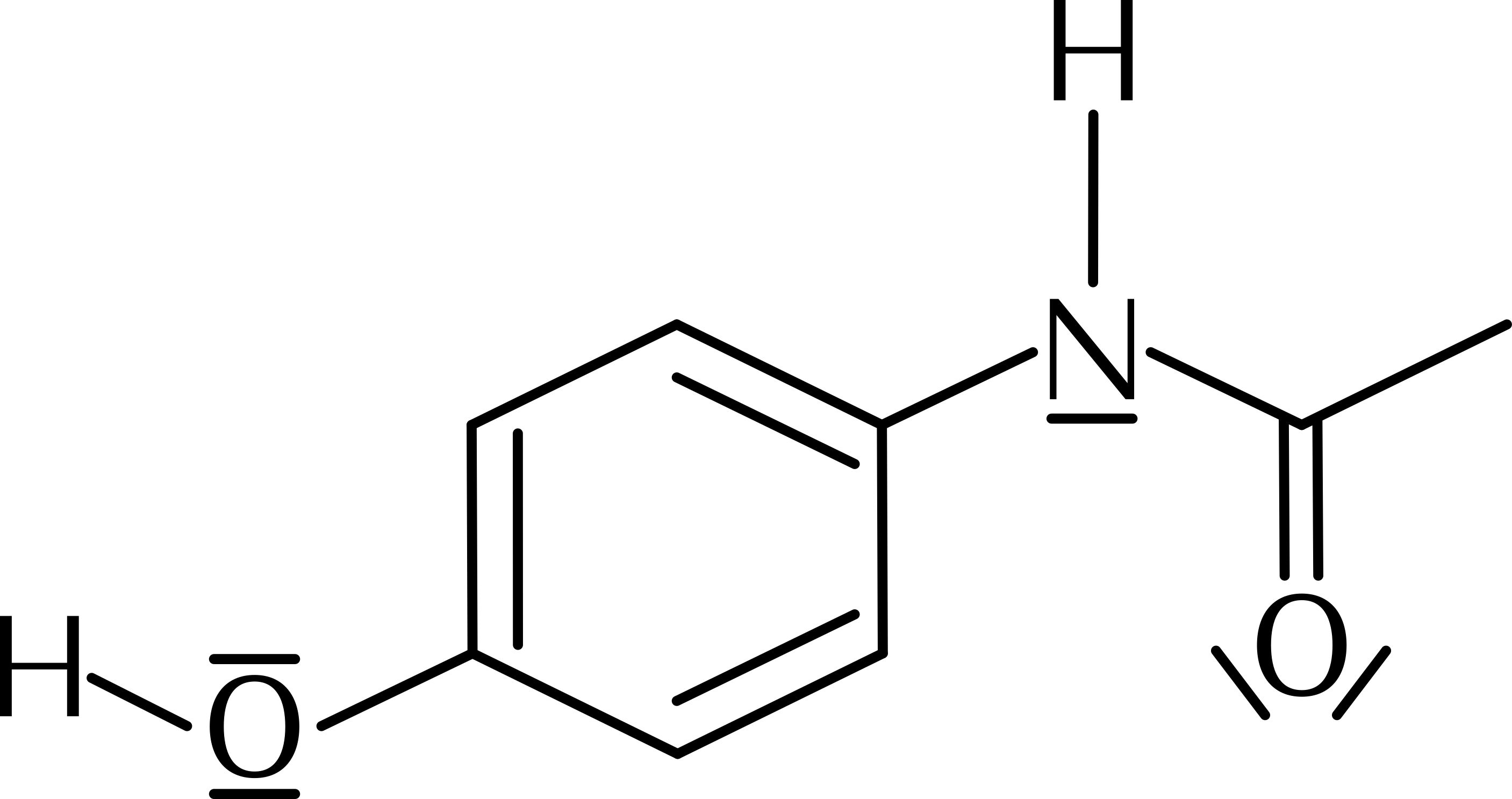
Natriumcitrat, ein Anticoagulanz für Blutproben, ist das Natriumsalz der dreiwertigen Zitronensäure: C6H5O73−(Na+)3. Codeinum phosphoricum ist ein Analgetikum. Es wird als Salz der korrespondierenden Säure des Codeins, C18H21NO3, vertrieben.
Aufgabe 13.1
(a) Erstellen Sie die Lewis-Formel von Citrat (Seite 153). ![]()
(b) Erstellen Sie die Ionenformel von Codeindihydrogenphosphat.
13.3.2 Verknüpfung (Seite 153 sorgfältig lesen)
Die Verknüpfung der Atome (Konstitution) bestimmt maßgeblich die Eigenschaften einer Verbindung. Stoffe mit derselben Zusammensetzung und verschiedenen Konstitutionen haben verschiedene Eigenschaften.
Die Summenformel C2H6O kann für zwei verschiedene Verbindungen, Ethanol CH3−CH2−OH oder Dimethylether CH3−O−CH3 stehen. In diesen zwei Verbindungen liegen unterschiedliche Verknüpfungen vor. Ethanol welches eine OH-Gruppe besitzt reagiert mit Natrium unter Wasserstoffbildung während Dimethylether keine Reaktion eingeht.
Aufgabe 13.2 ![]() Erstellen Sie die Reaktionsgleichung, der Reaktion, die beim Trocknen von Diethylether stattfindet.
Erstellen Sie die Reaktionsgleichung, der Reaktion, die beim Trocknen von Diethylether stattfindet.