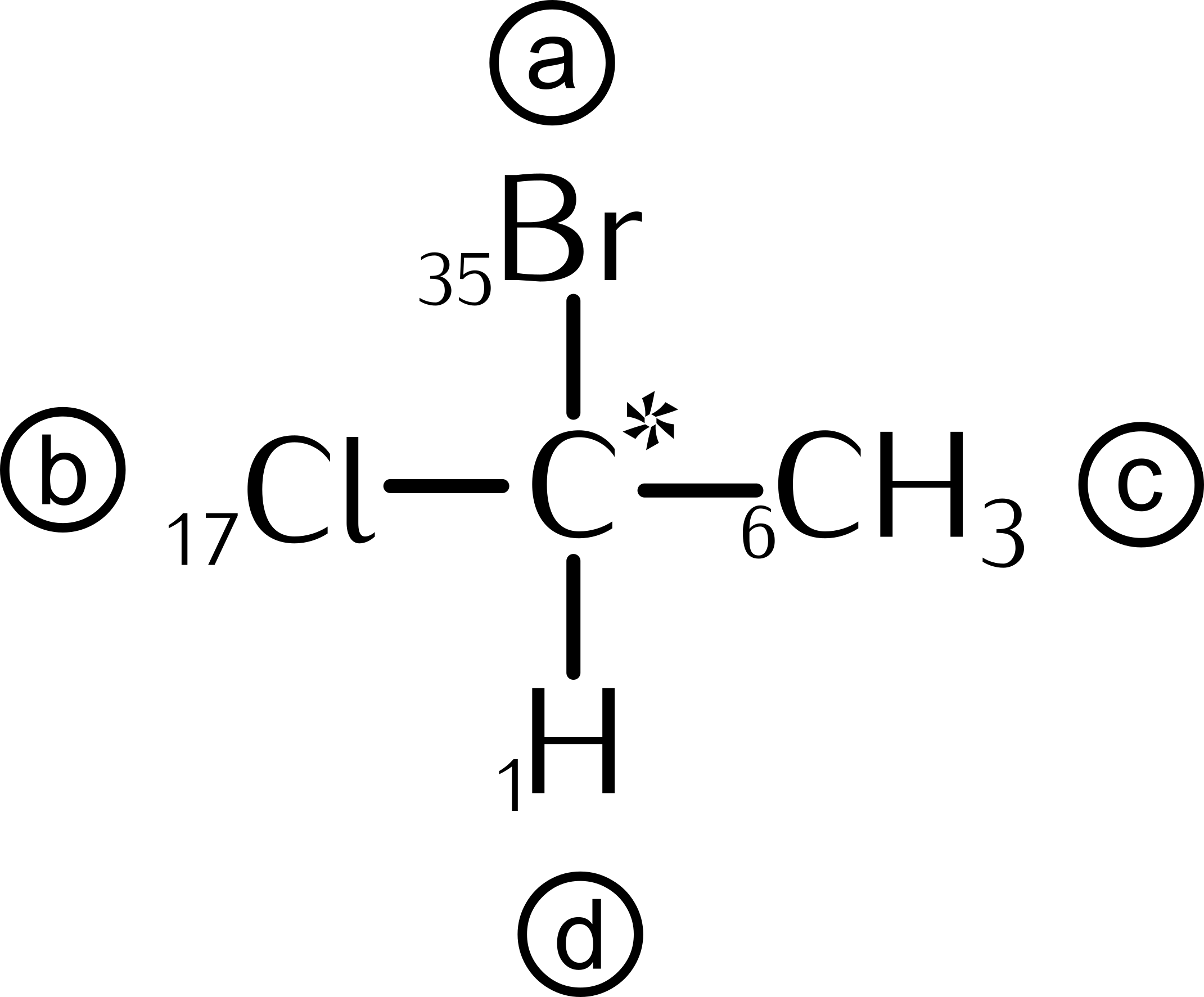
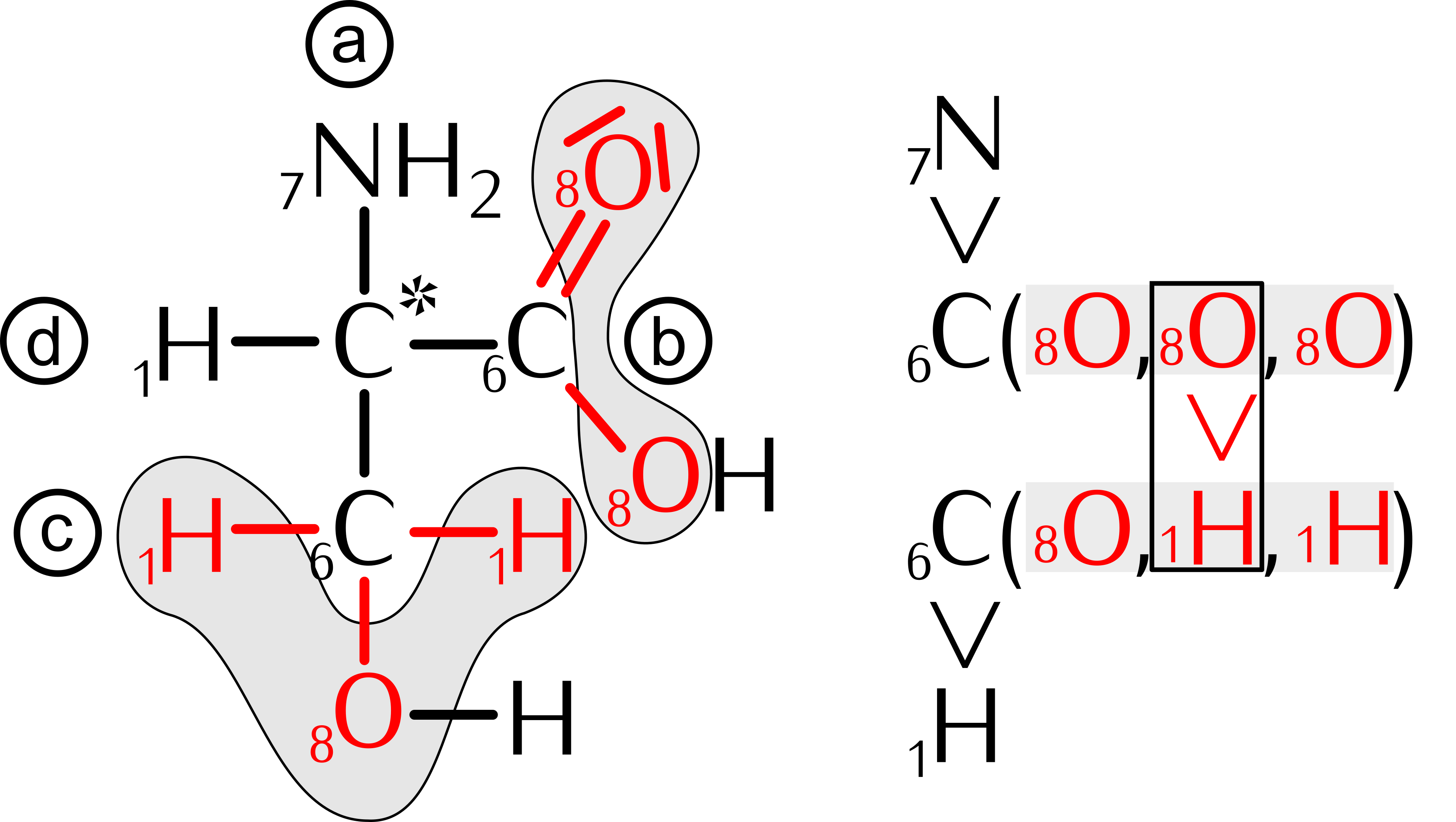
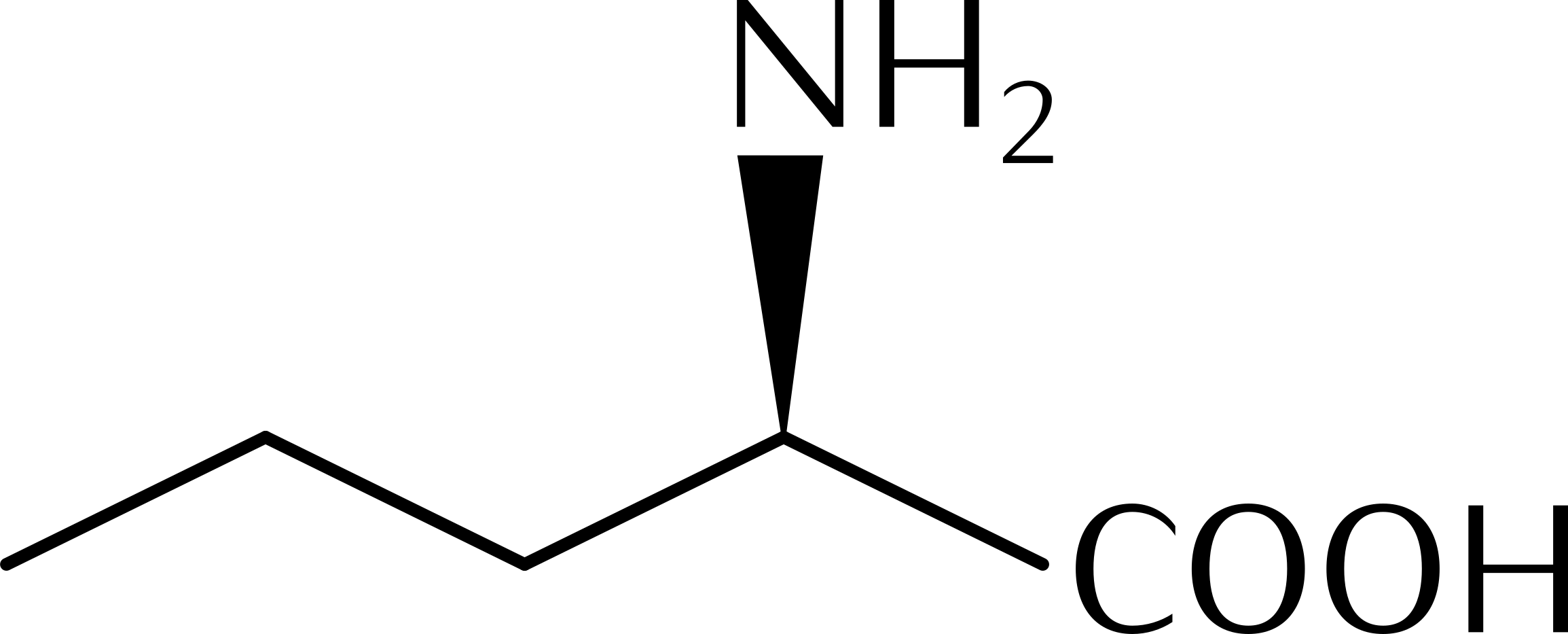
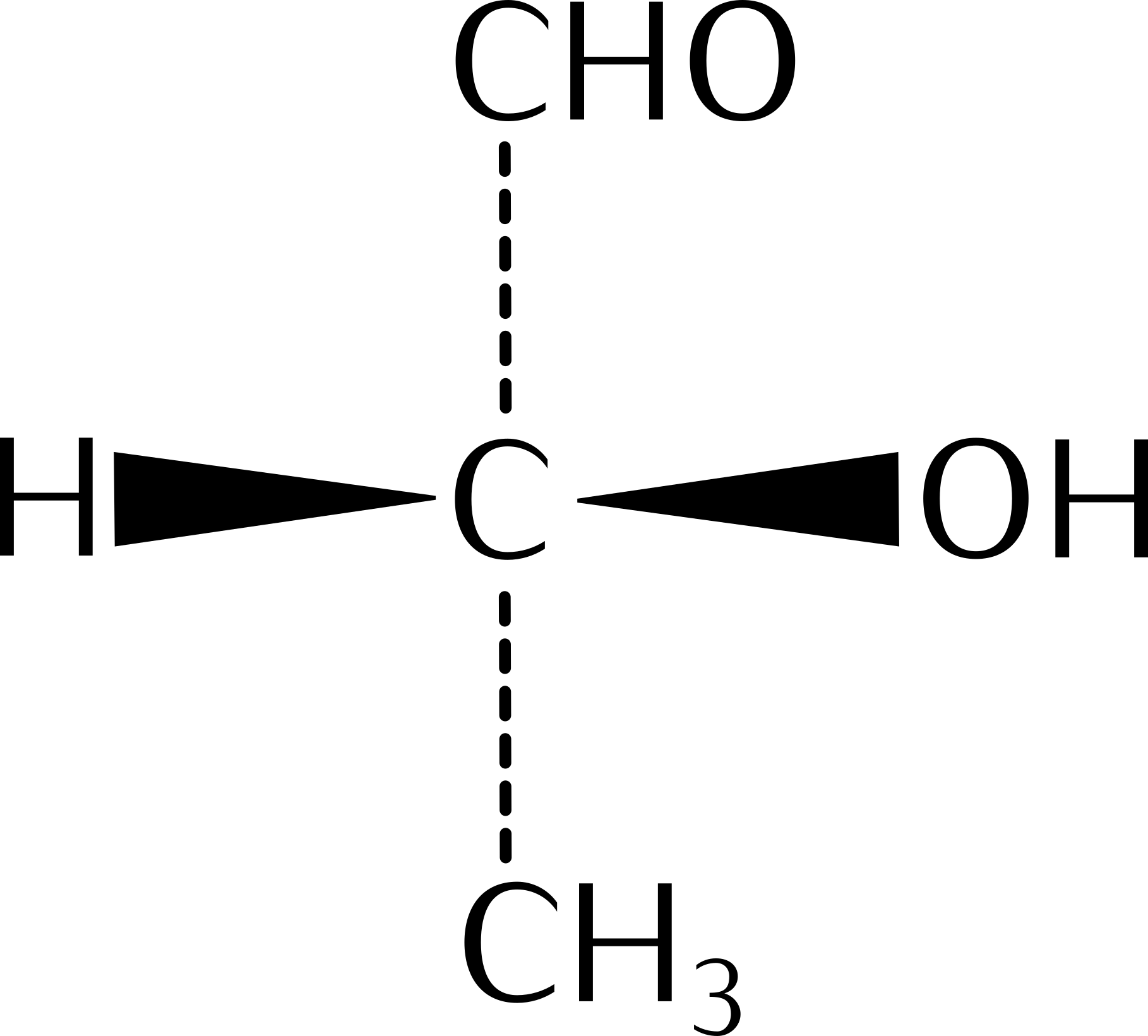
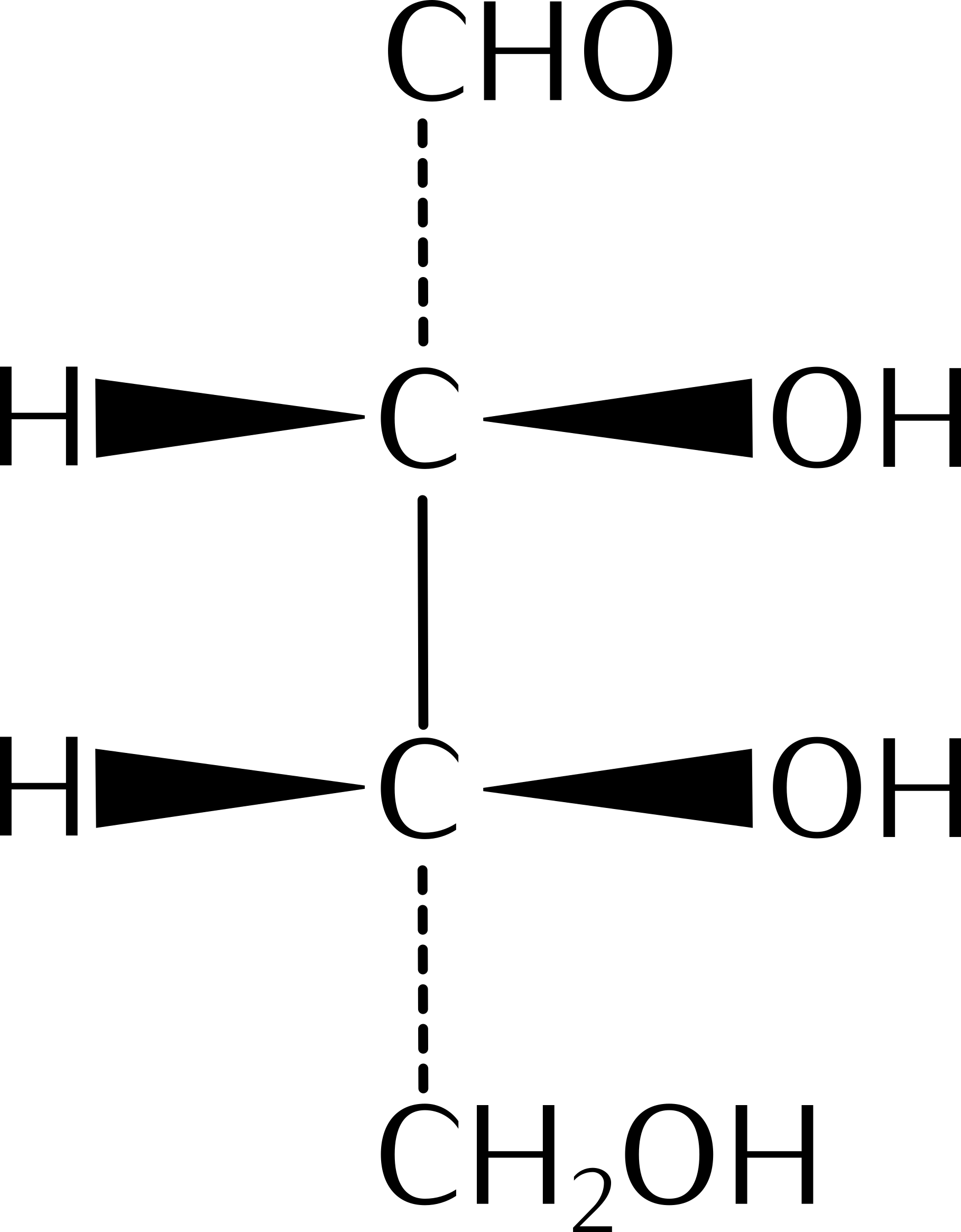
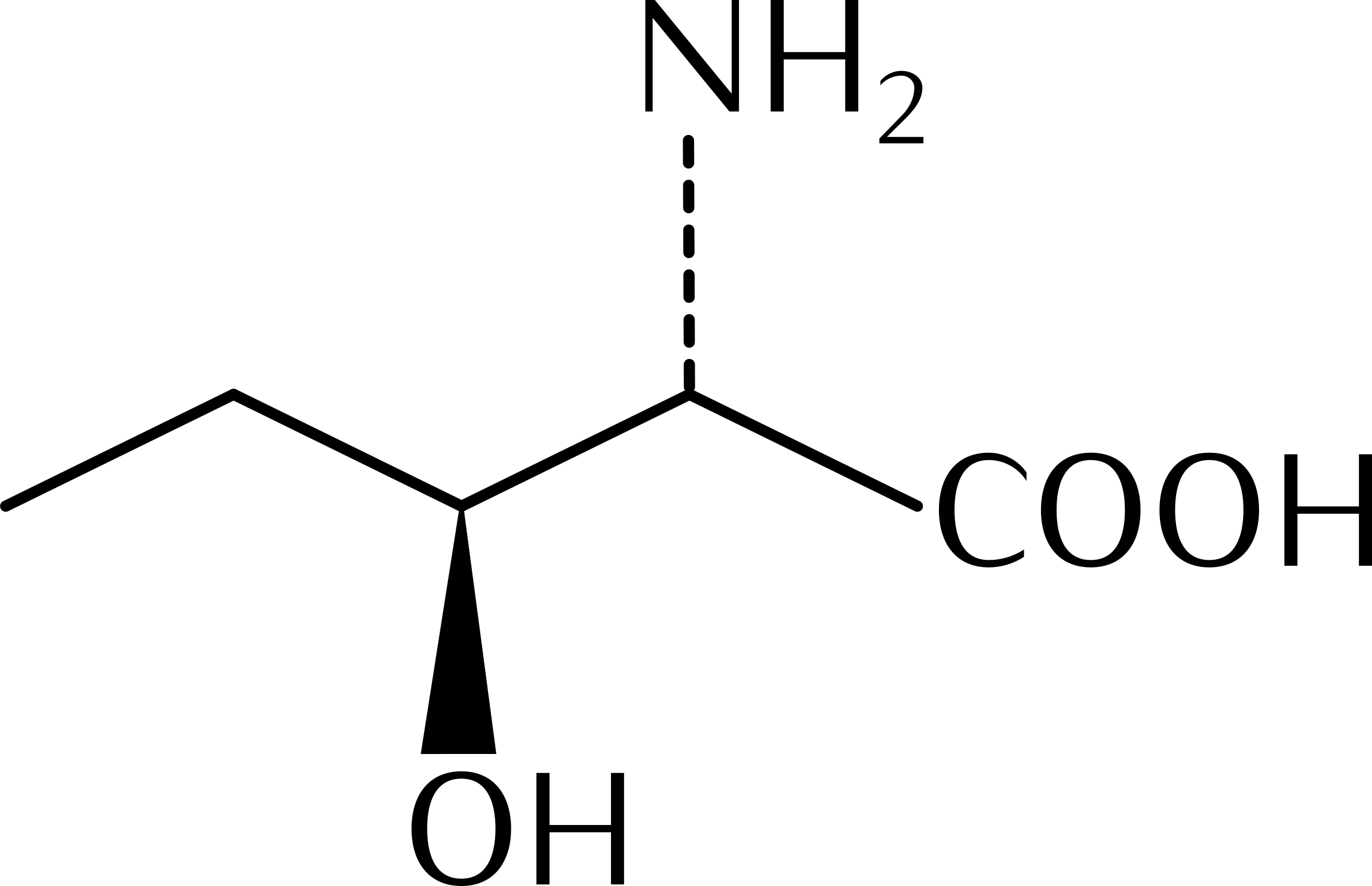
15.10 Reaktionen chiraler Verbindungen
Seite 200 - 202 durchlesen
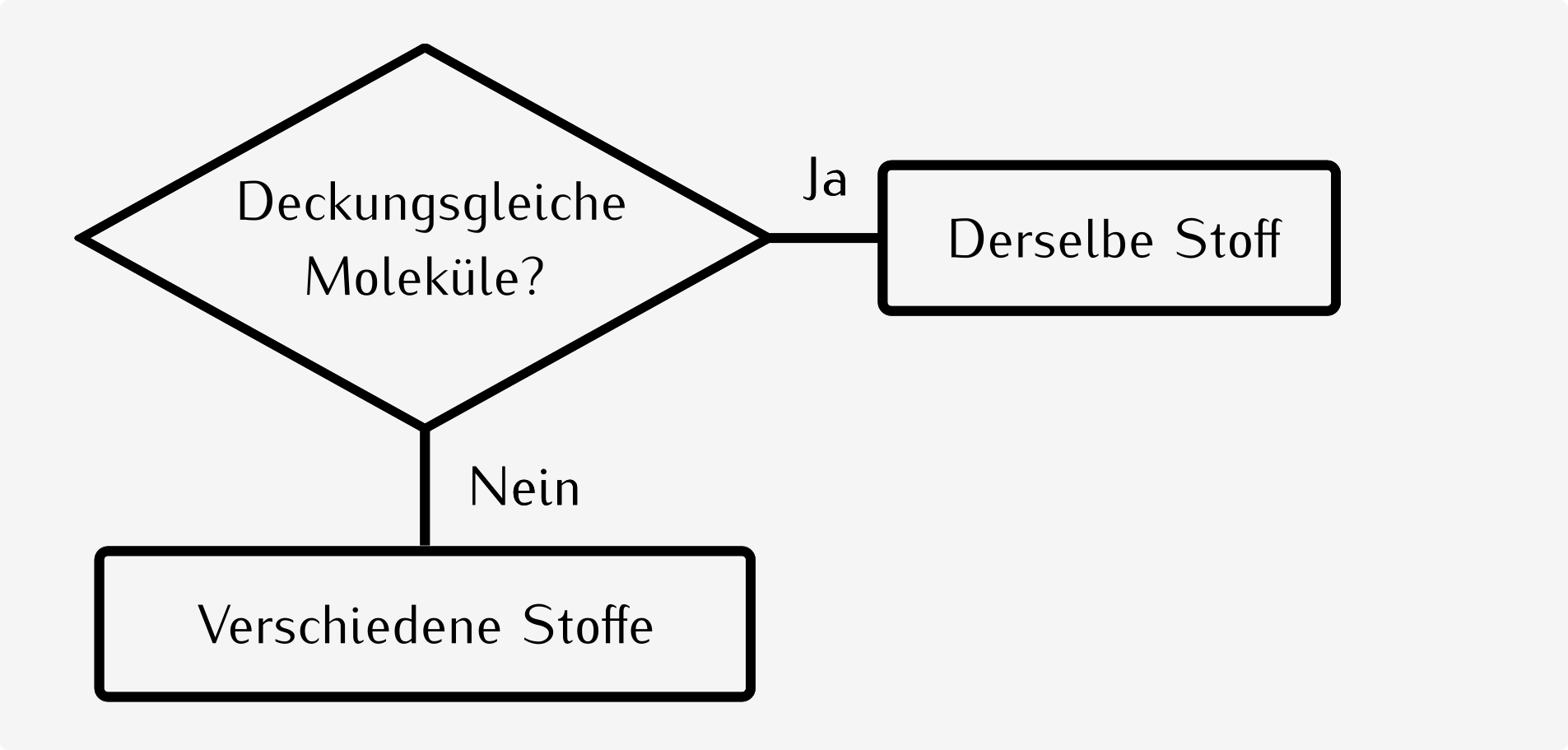
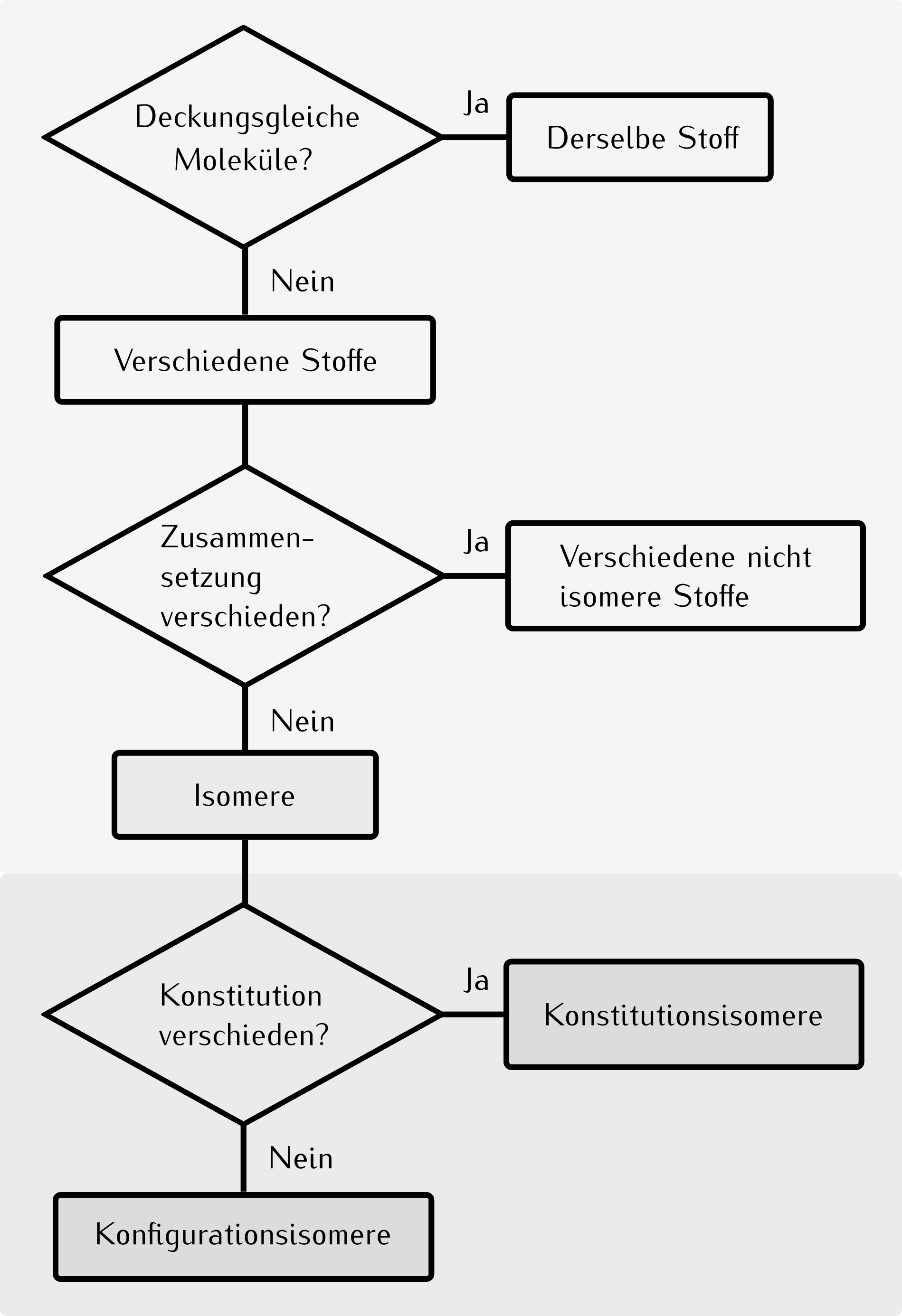
15.11 Diastereomere
Definition
Diastereomere sind nicht spiegelbildliche Konfigurationsisomere. |
Diastereomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften. |
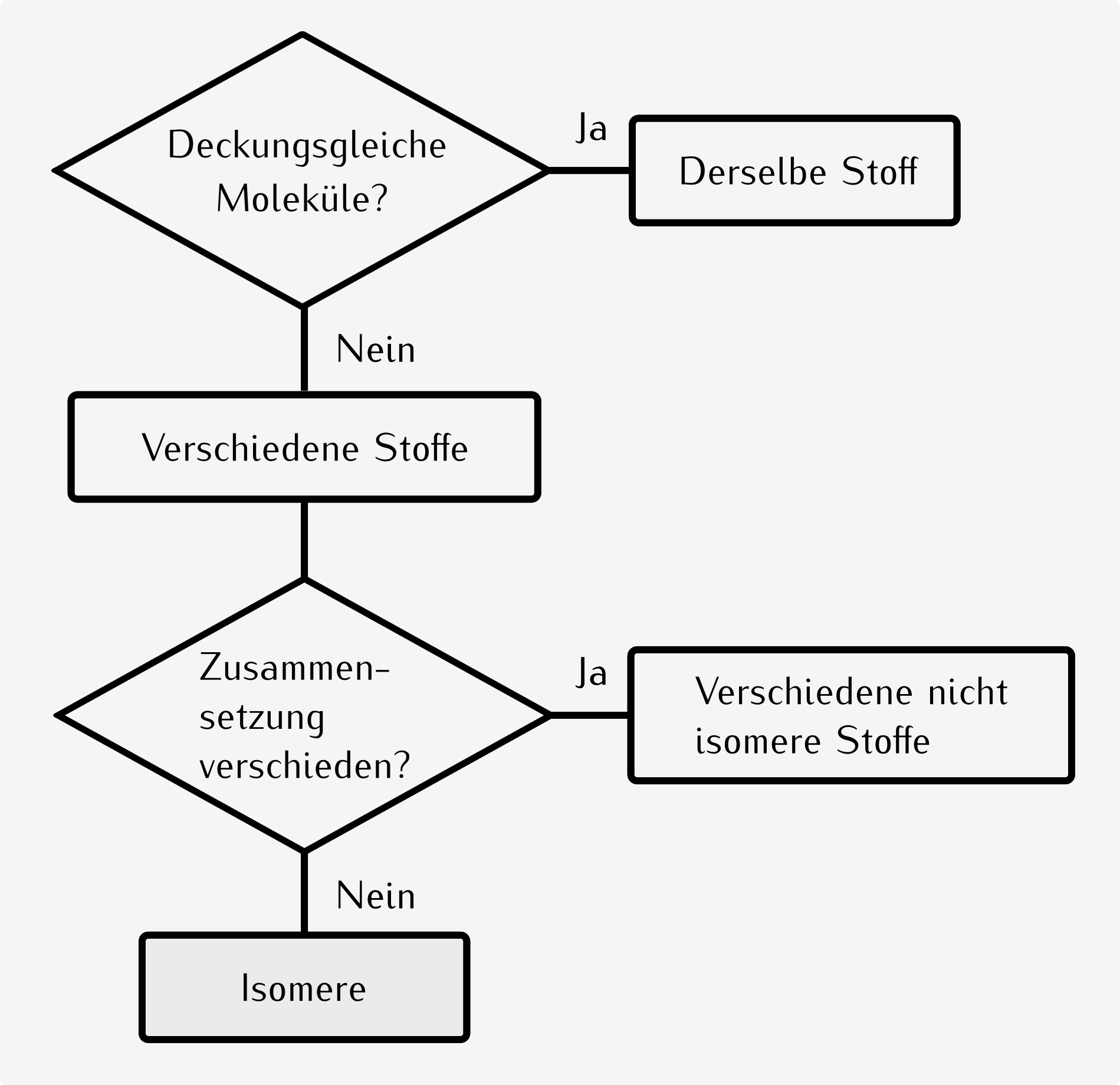
15.12 Erkennen von Diastereomeren
Seite 202 - 203 sorgfältig lesen
15.13 Nomenklatur geometrischer Isomere
Die Konfigurationen werden mit Deskriptoren angegeben.
15.13.1 cis-trans-Deskriptoren
Traditionell werden für die Bezeichnung der geometrischen Isomere die cis-trans-Deskriptoren verwendet. Deren Anwendung ist jedoch an eine Bedingung geknüpft.
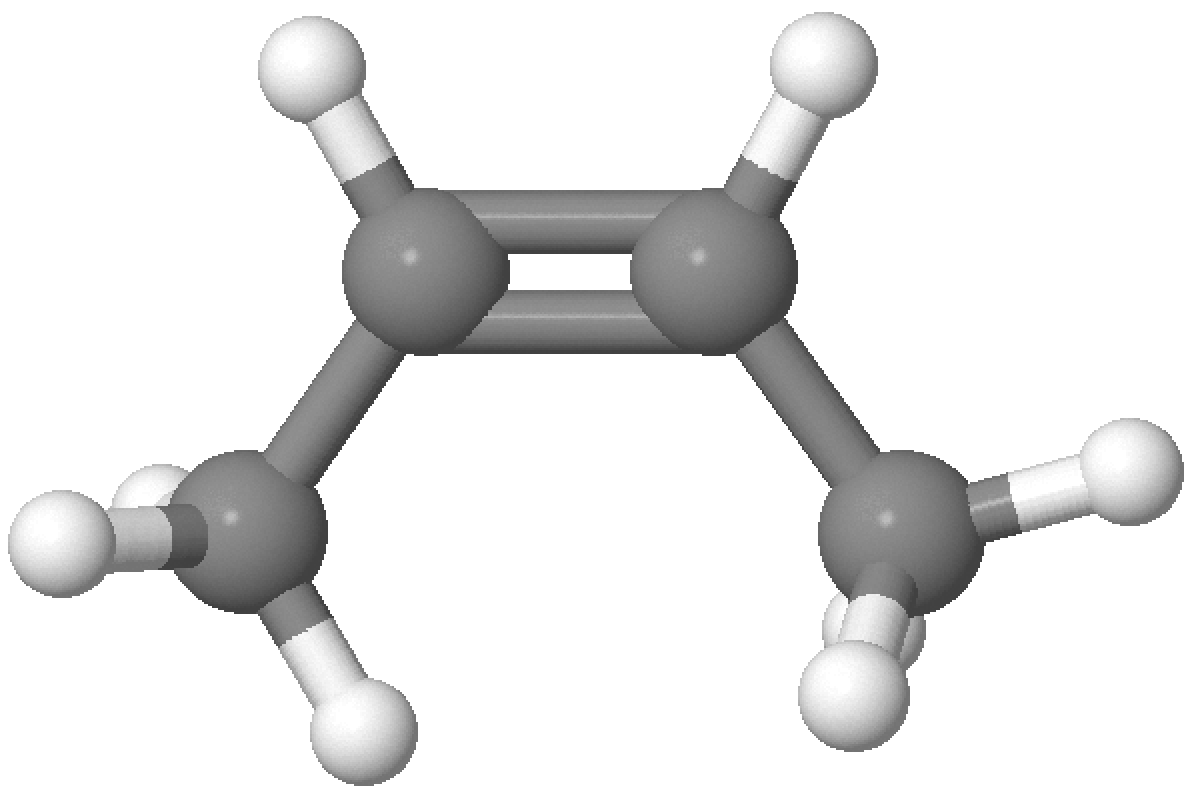
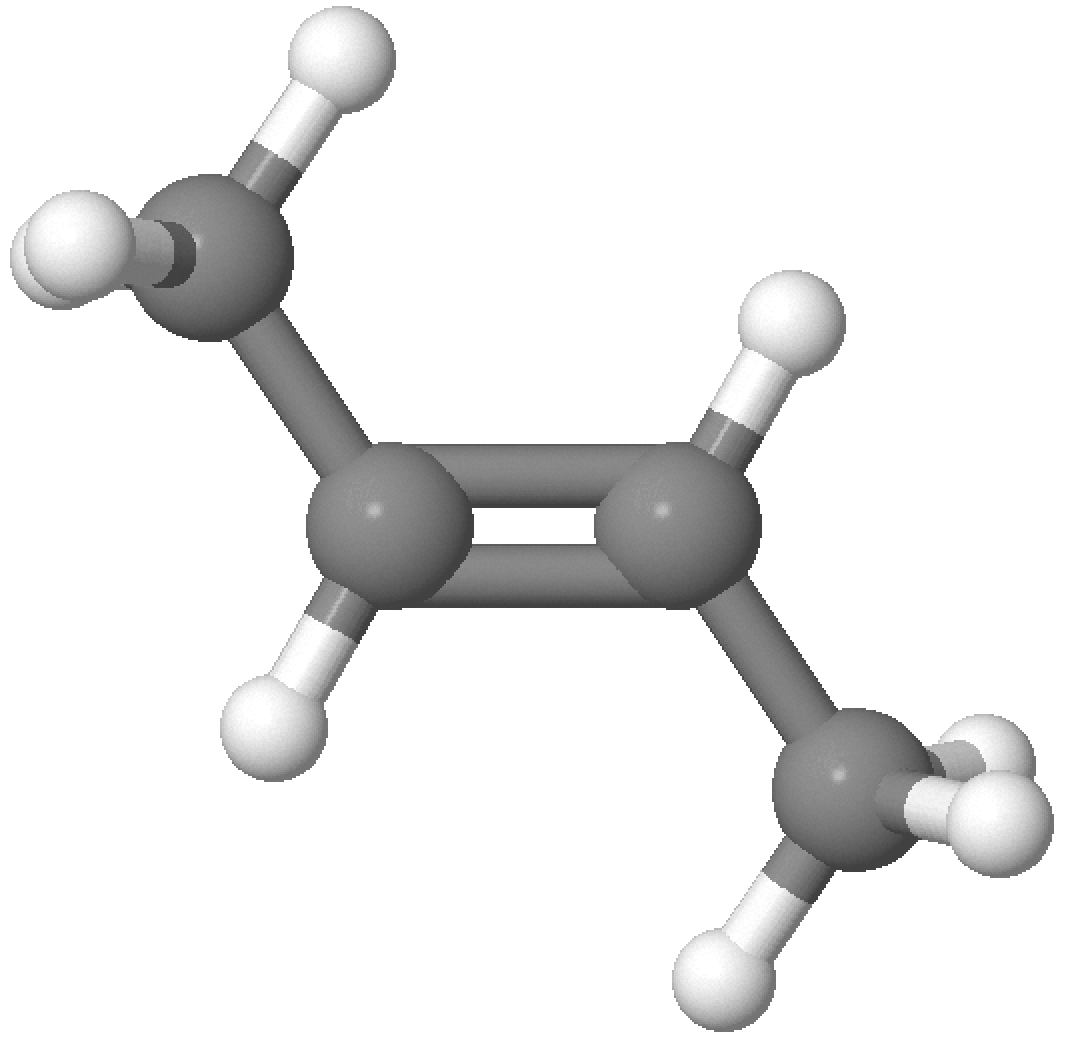
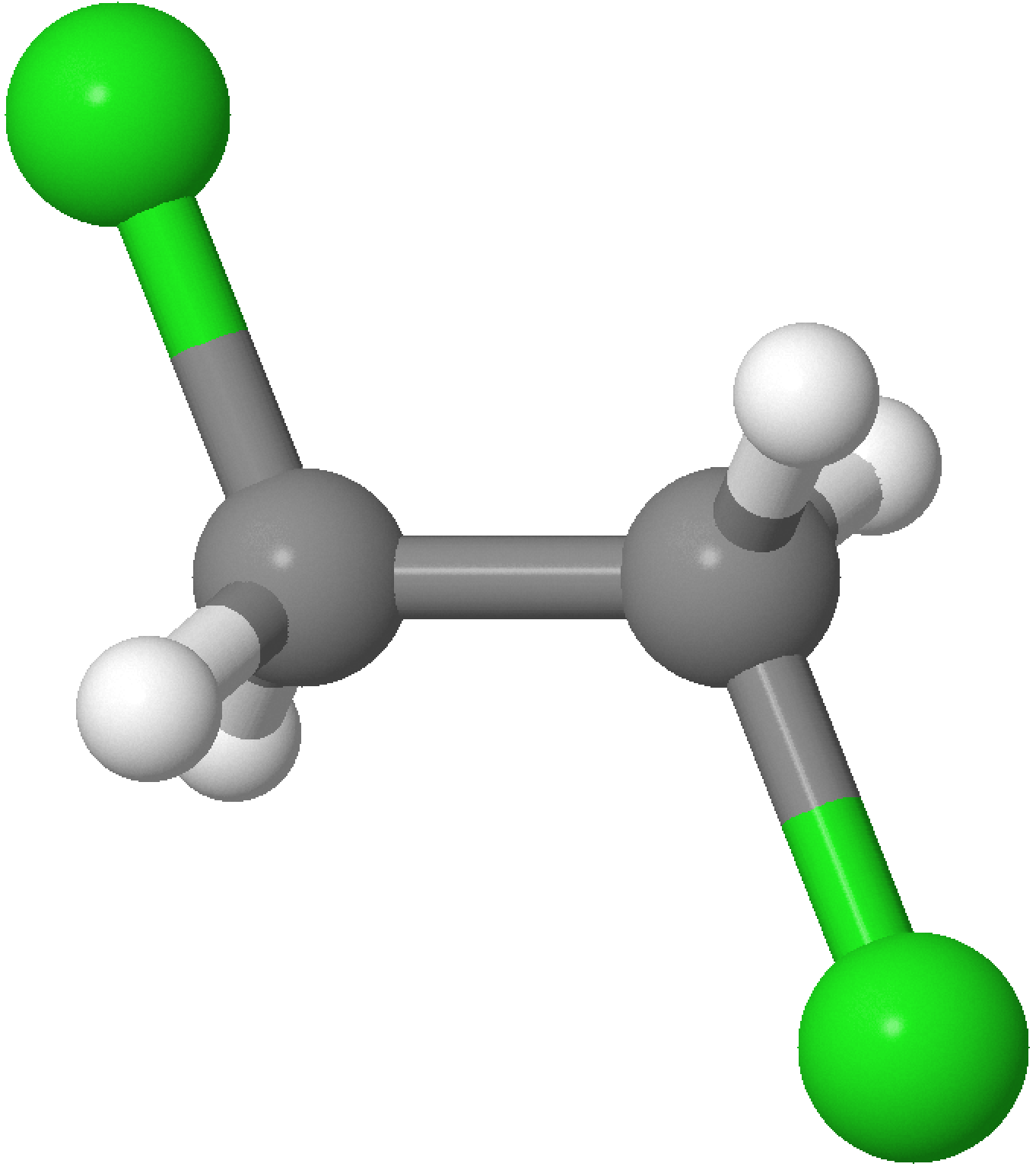
An beide C-Atome ist jeweils nur ein H-Atom gebunden. Die relative Stellung der H-Atome wird als cis, auf der gleichen Seite, oder trans, auf der gegenüberliegenden Seite der Doppelbindung bezeichnet. Wenn keine zwei einzelnen H-Atome vorhanden sind, sind die cis und trans Deskriptoren nicht anwendbar. Die cis und trans Deskriptoren werden mit Bindestrich dem Namen vorangestellt.

Beispiel
(siehe Seite 203 - 204)




15.13.2 E-Z-Deskriptoren nach CIP
Bei allen geometrischen Isomeren, kann die CIP-Priorisierung der Substituenten verwendet werden.
Für jedes C-Atom wird festgestellt welcher der beiden Substituenten nach CIP prioritär ist ⓐ und welcher nicht ⓑ. Die relative Stellung der jeweils prioritären Substituenten wird bezeichnet als Z, zusammen, auf der gleichen Seite, oder E, entgegen, auf gegenüberliegenden Seiten der Doppelbindung. Die E-Z-Deskriptoren werden auch dem Namen mit Bindestrich und in Klammern vorangestellt. Mehrere Deskriptoren werden durch Kommata getrennt und es wird ihnen ein Lokant vorangestellt.

Die uneingeschränkt anwendbaren und eindeutigen (E)-(Z)-Deskriptoren sind den cis-trans-Deskriptoren vorzuziehen.
Beispiel
(siehe Seite 204)
|