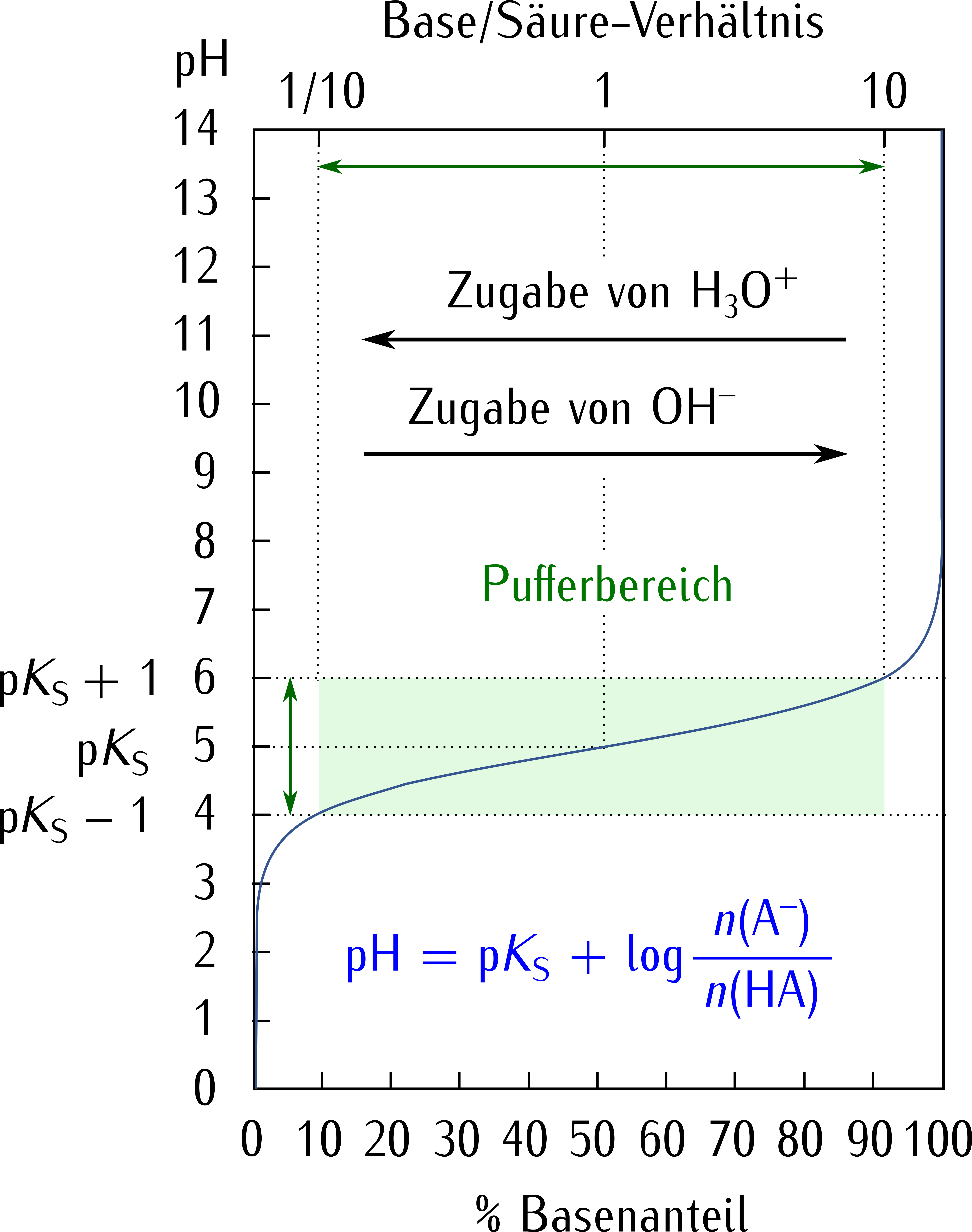
pH einer Pufferlösung: Henderson-Hasselbalch-Gleichung. |
|||||||||
|
|||||||||
Der pH-Wert der Pufferlösung variiert je nach Base/Säure Verhältnis um den pKS-Wert der schwachen Säure des Puffersystems. |
Aufgaben
1. Eine Pufferlösung wird aus 2,00 g Ammoniumchlorid und 1000 mL Ammoniaklösung (c = 0,020 mol/L) hergestellt. Berechnen sie den pH-Wert. ![]()
2. 2,0 mL Salzsäure (c = 0,50 mol/L) werden zu 100 mL eines äquimolaren 0,10 mol L−1 CH3COOH/CH3COONa-Puffers gegeben. Berechnen Sie den pH-Wert vor und nach der Zugabe der Salzsäure. ![]()
3. 2,0 mL NaOH 1,0 M werden zu 250 mL eines 0,10 mol/L CH3COOH/CH3COONa-Puffers gegeben. Berechnen Sie den pH-Wert vor und nach der Zugabe der Natronlauge. ![]()