8 Säure-Base-Titrationen
8.1 Neutralisationsreaktion
Basen und Säuren haben gegenteilige Eigenschaften. Bei der Reaktion zwischen Säure und Base heben diese sich gegenseitig in ihren Eigenschaften auf. Eine Säure kann mit einer Base und eine Base mit einer Säure in ihrer Wirkung neutralisiert werden. Die Neutralisation entspricht einem Protonenübergang
CH3COOH(aq) + NH3(aq) → CH3COO−(aq) + NH4+(aq)
Für eine vollständige Neutralisation sollte am besten einer der beiden Reaktionspartner eine starke Säure oder Base sein und die eingesetzten Stoffmengen das stöchiometrische Verhältnis von Säure und Base abbilden.
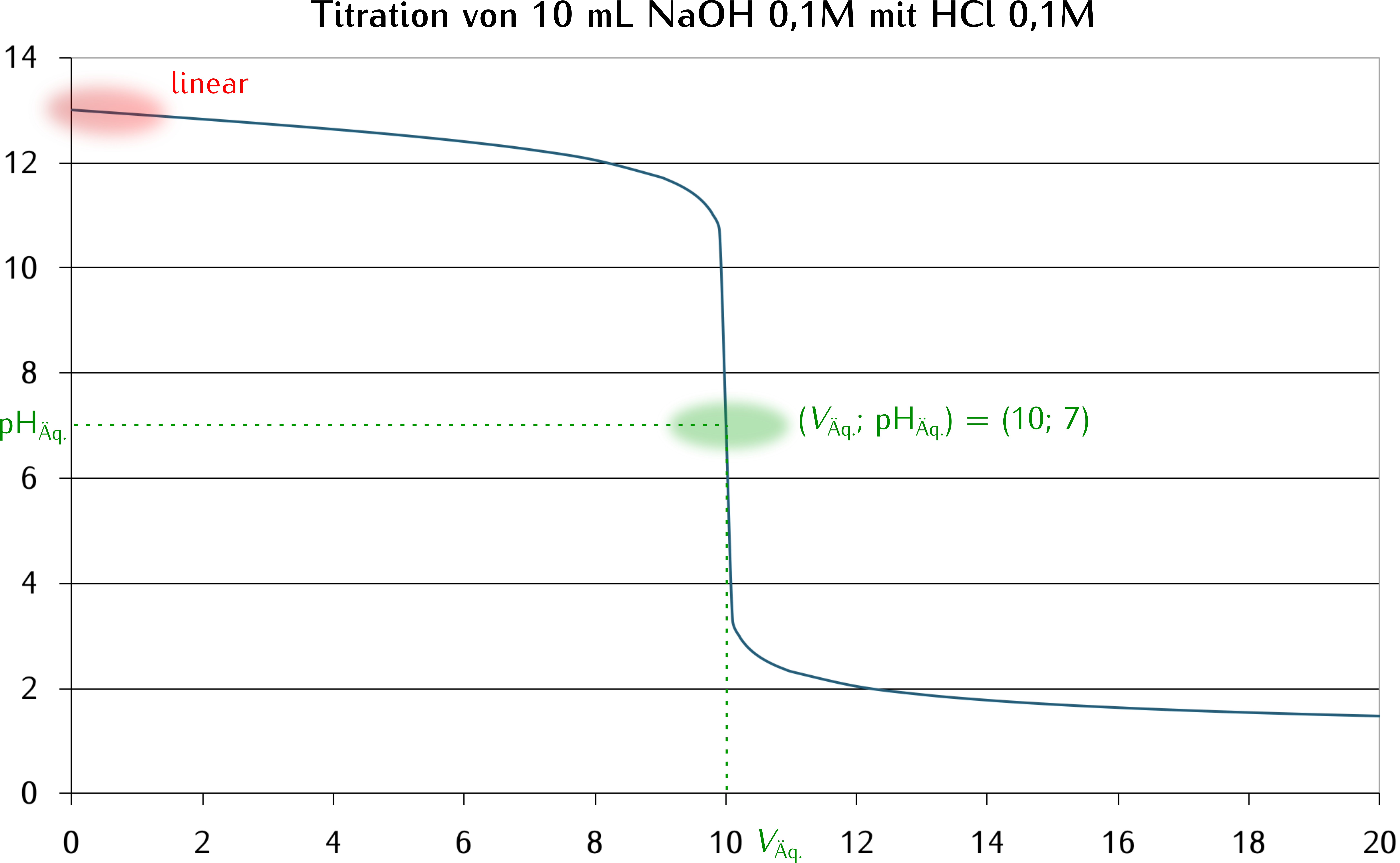
Die Neutralisation einer starken Säure mit einer starken Base oder einem Hydroxid ergibt eine neutrale Lösung.
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
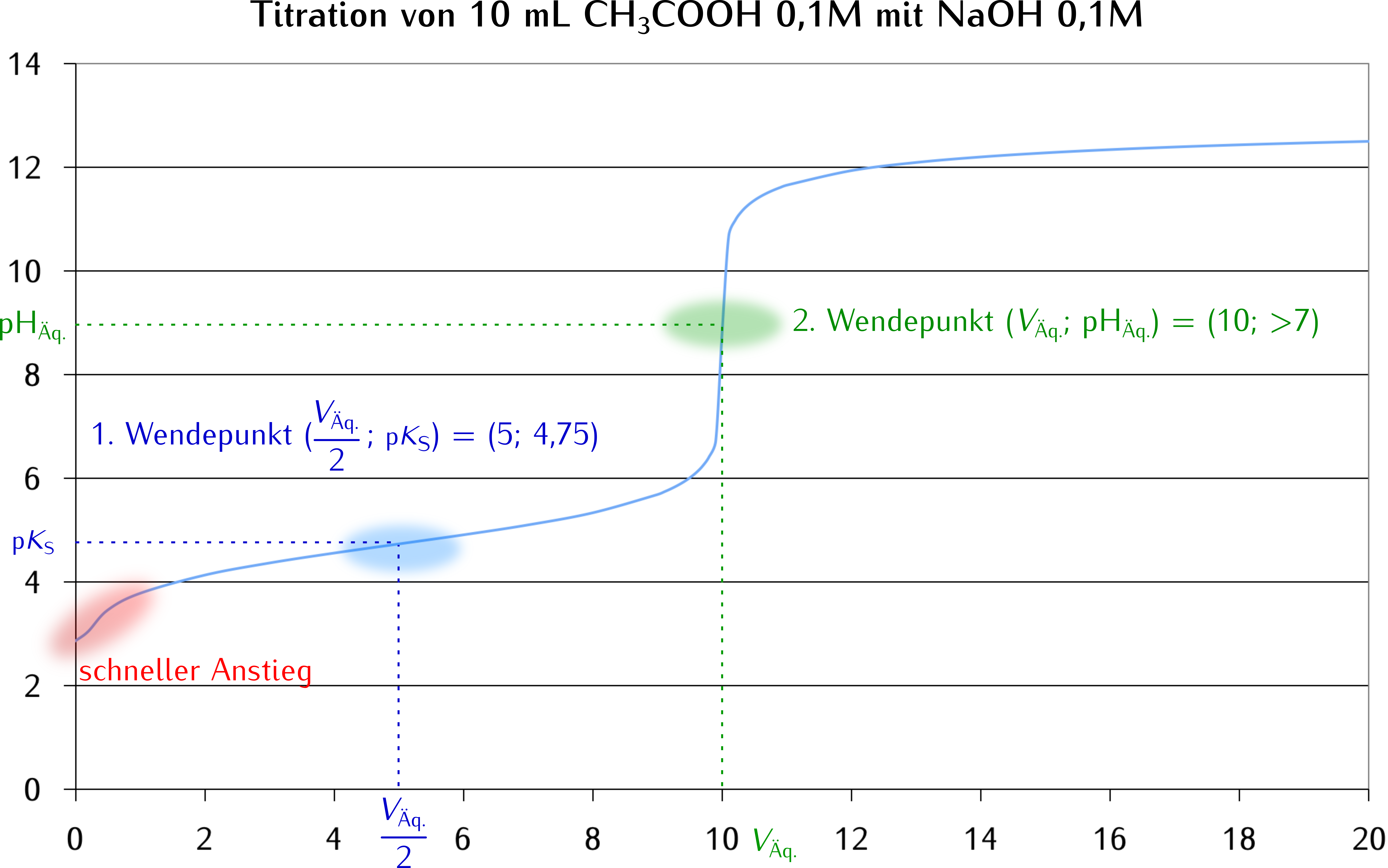
Die Neutralisation einer schwachen Säure mit einer starken Base oder Hydroxid ergibt eine basische Lösung. Aus der schwachen Säure wird die korrespondierende schwache Base gebildet.
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
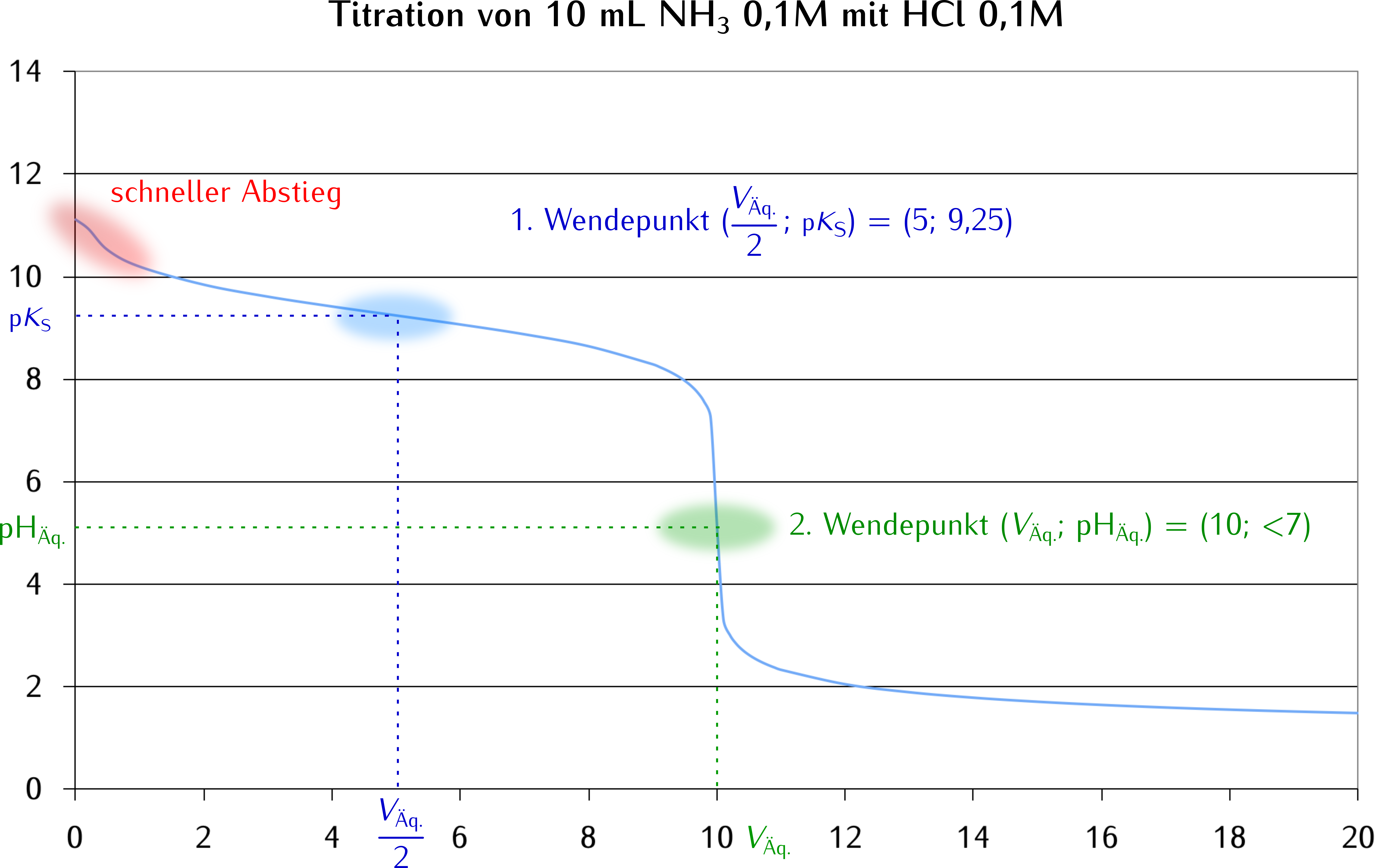
Die Neutralisation einer schwachen Base mit einer starken Säure ergibt eine saure Lösung weil aus der schwachen Base die korrespondierende schwache Säure gebildet wird.
HCOONa(aq) + HCl(aq) → HCOOH(aq) + H2O(l)
Aufgabe
Sodbrennen entsteht durch überschüssige Magensäure (HCl 0,5 %) welche mit »Bullrich Salz Magentabletten« neutralisiert werden kann. Magensäure enthält Salzsäure mit einem Massenanteil von 0,5 %. Für die Dichte kann 1,0 g/mL angenommen werden.
Berechnen Sie welches Volumen an Magensäure mit einer Tablette mit 850 mg NaHCO3 neutralisiert wird. ![]()
8.2 Maßanalyse
Die Maßlanalyse oder Titrimetrie ist eine Methode zur quantitativen Bestimmung eines Stoffes (Analyt) in einem Stoffgemisch (Probe). Sie beantwortet die Frage, wie viel Analyt in der Probe enthalten ist.
I. Prinzip
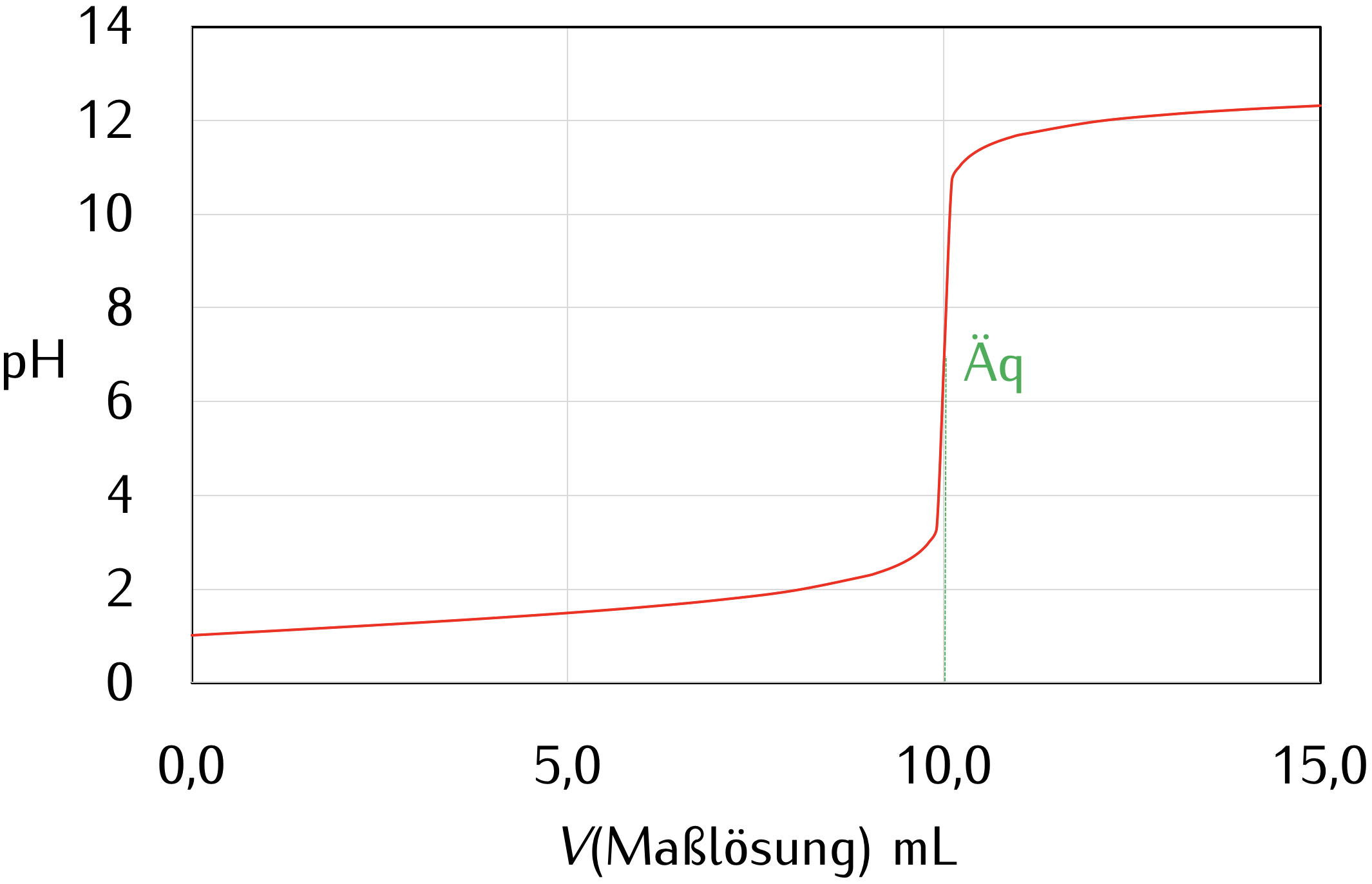
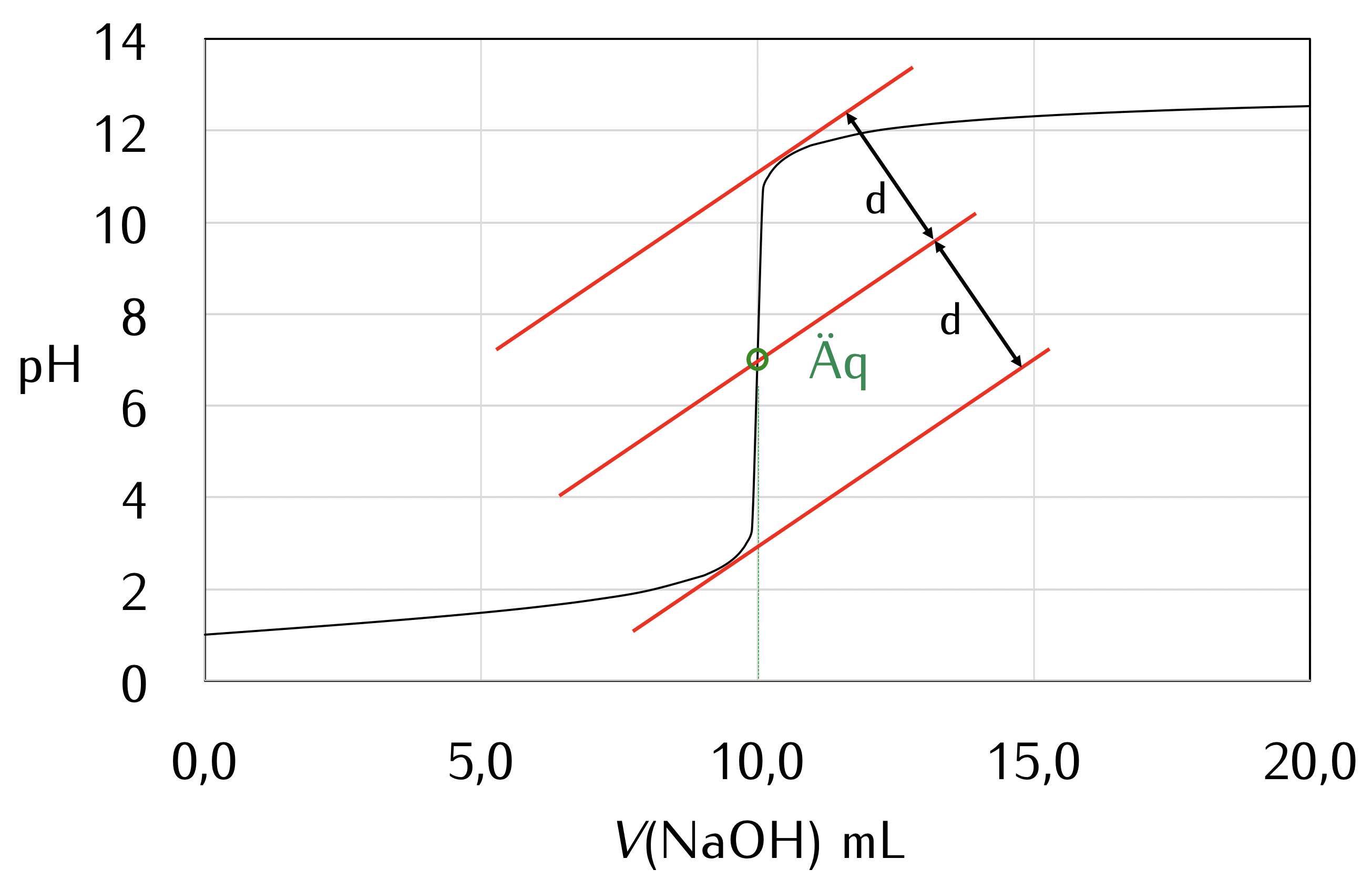
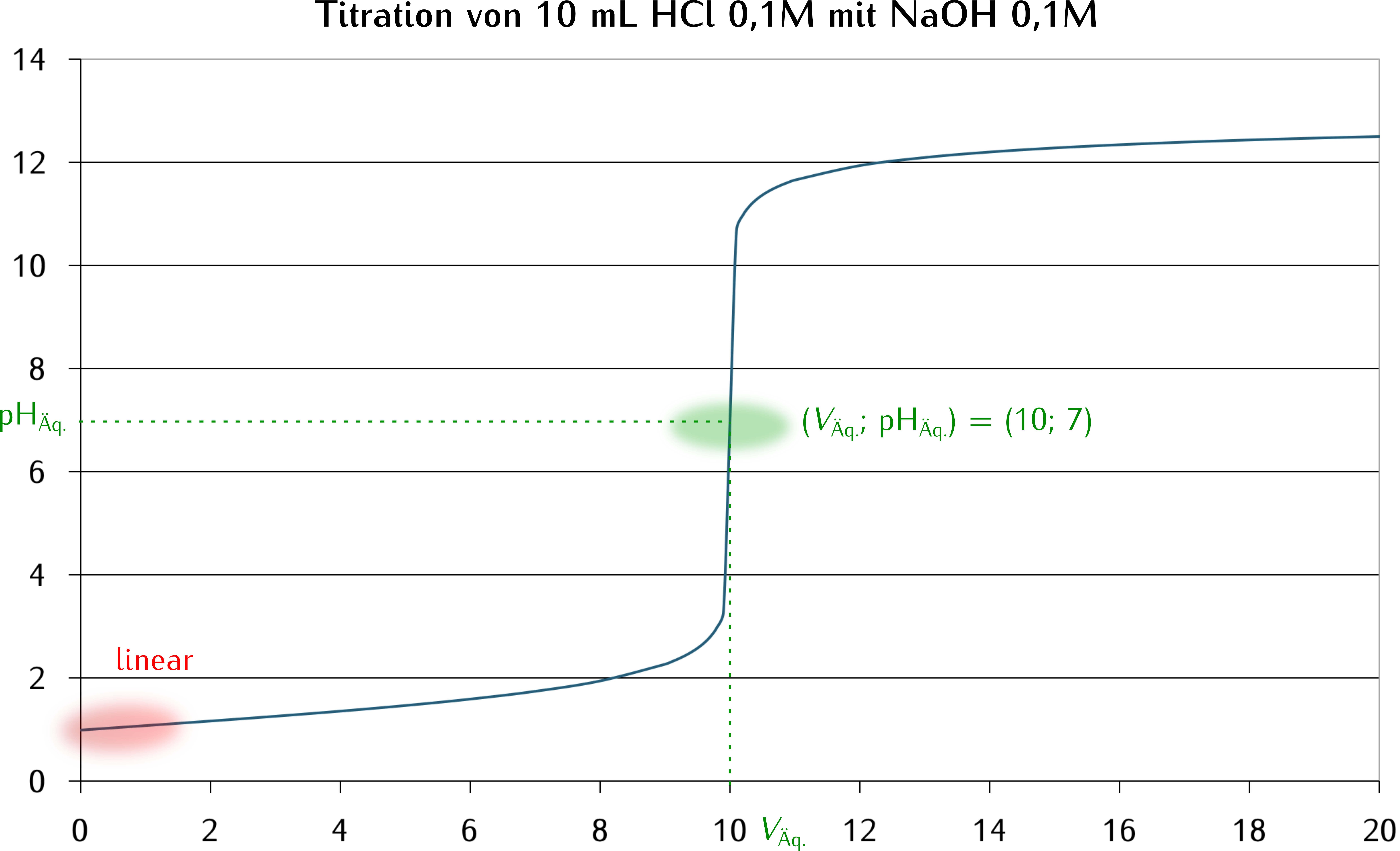
Zu einem bestimmten Volumen der Probelösung wird genau so viel Reagenzlösung bekannter Konzentration (Maßlösung) hinzugegeben, wie zur vollständigen Umsetzung des Analyten erforderlich ist. Aus der Konzentration der Maßlösung und dem Volumen, das zum Erreichen der vollständigen Umsetzung (äquivalenzpunkt) benötigt wird, lässt sich die Menge des Analyten berechnen. Der äquivalenzpunkt muss durch eine geeignete Methode klar erkennbar sein.