(2) Geben Sie die Kurzschreibweise (Zelldiagramm) dieser galvanischen Zelle an.
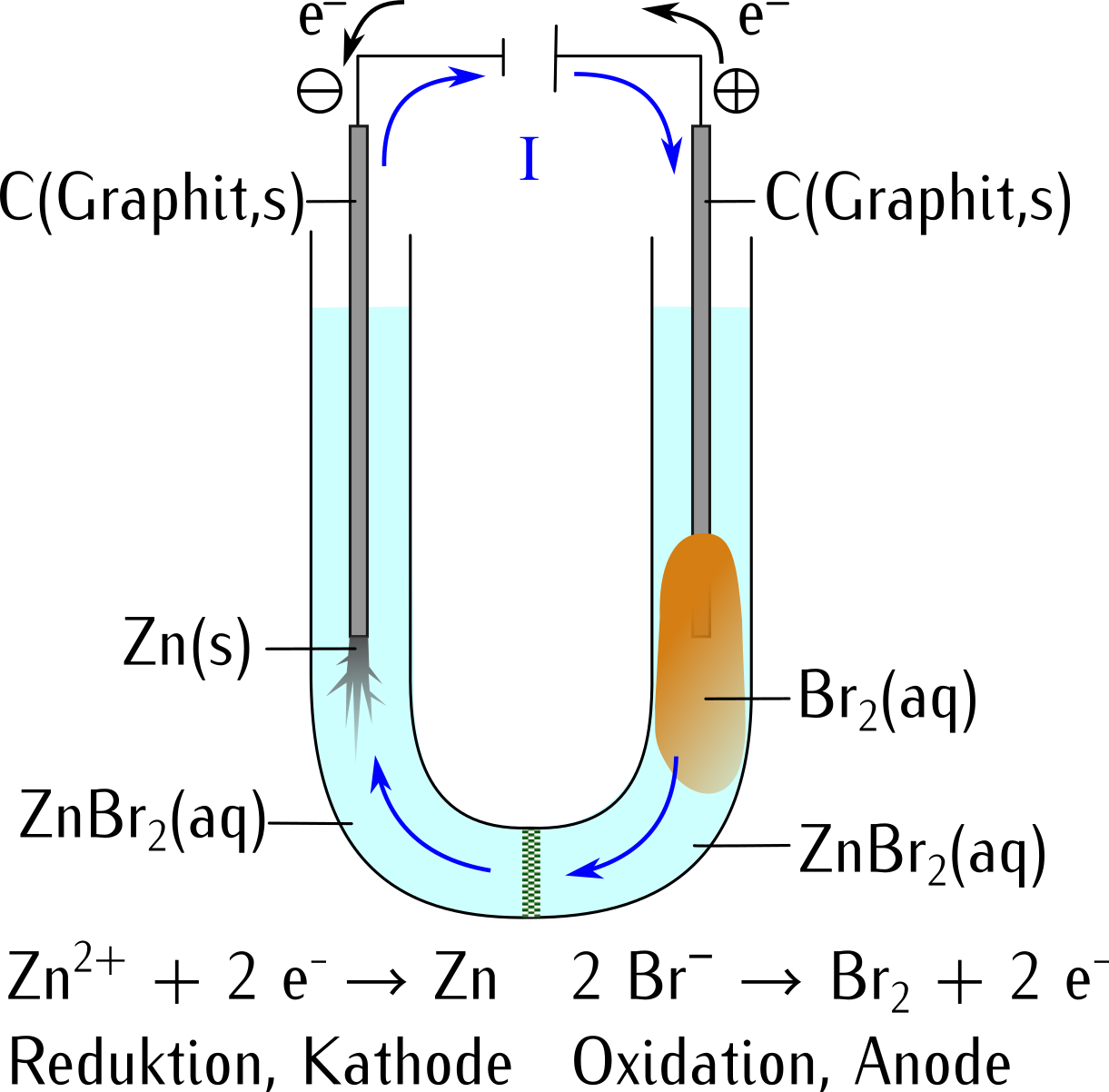
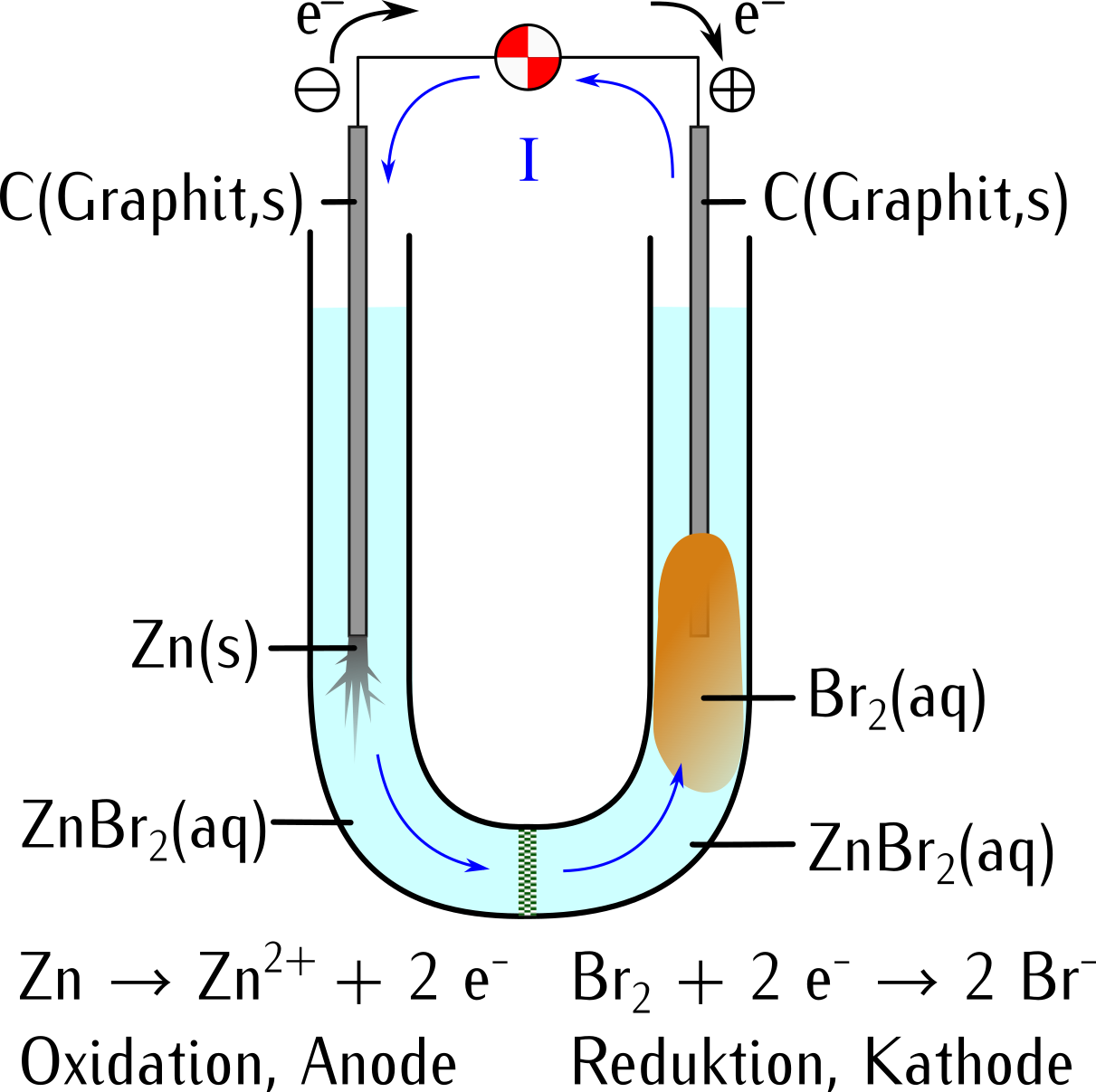
10.3 Gegenüberstellung Elektrolysezelle und galvanische Zelle
| In einer Elektrolysezelle wird eine nicht spontane Redoxreaktion erzwungen. |
|
In einer galvanischen Zelle findet eine spontane Redoxreaktion statt. |
| Eine Elektrolysezelle verbraucht Strom aus einer Gleichstromquelle. |
|
Eine galvanische Zelle produziert Strom wenn ein Verbraucher angeschlossen ist. |
| In der Elektrolysezelle wird am ⊕-Pol der Gleichstromquelle durch Elektronenmangel eine Oxidation (Anode) erzwungen. |
|
Im galvanischen Element lädt die Oxidation (Elektronenabgabe) die Anode negativ auf (⊖-Pol). |
| In der Elektrolysezelle wird am ⊖-Pol-Pol durch Elektronenüberschuss eine Reduktion (Kathode) erzwungen. |
|
Im galvanischen Element lädt die Reduktion (Elektronenannahme) die Kathode positiv auf (⊕-Pol). |
| Der Strom fliesst durch die Elektrolysezelle vom ⊕-Pol zum ⊖-Pol der Gleichstromquelle. |
|
Der Strom fliesst durch einen Verbraucher vom ⊕-Pol zum ⊖-Pol der galvanischen Zelle. |
| Die Elektrolysezelle ist ein Verbraucher. |
|
Das galvanische Element ist eine Gleichstromquelle. |
| In der Elektrolysezelle wird elektrische Energie in chemische Energie umgewandelt. |
|
In der galvanischen Zelle wird chemische Energie in elektrische Energie umgewandelt. |