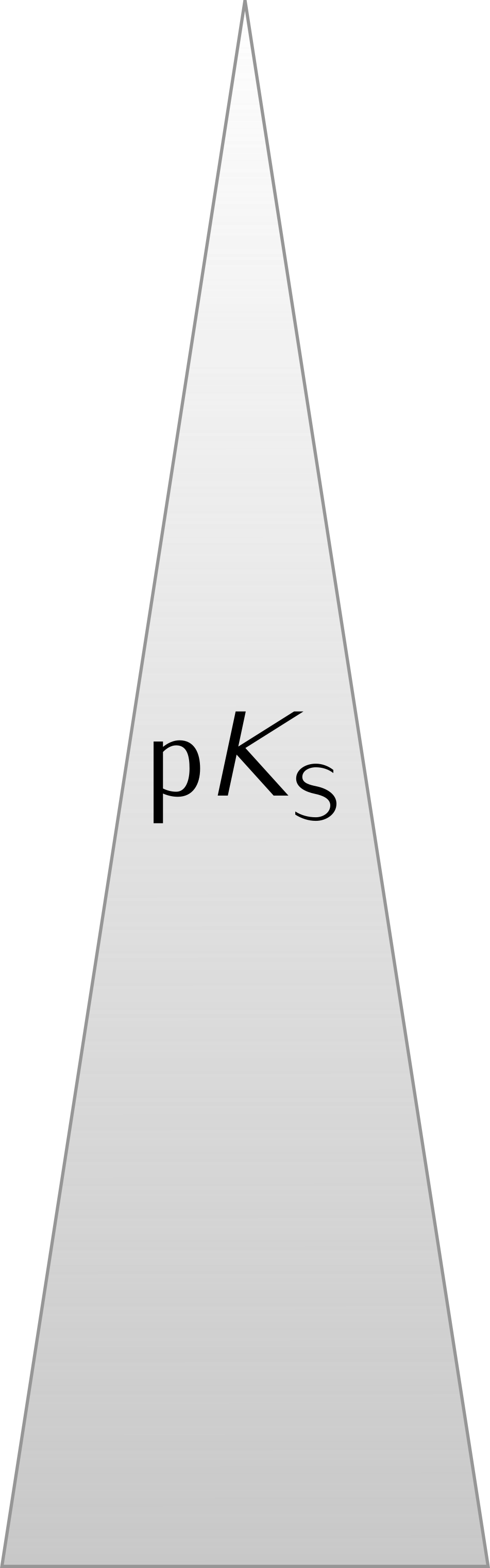
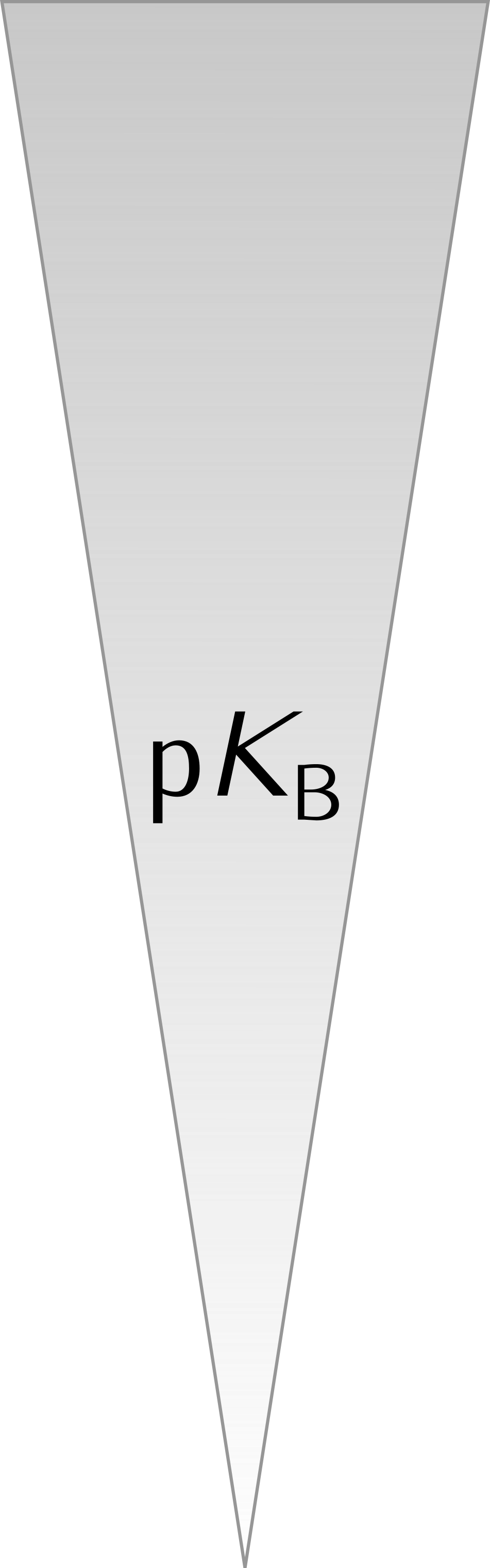
5 Stärke von Säuren und Basen
5.1 Starke, schwache und sehr schwache Säuren
Versuch
Die pH-Werte drei verschiedener wässriger Lösungen gleicher Konzentration werden mit einem kalibriertem pH-Meter oder gegebenenfalls Indikatorpapier bestimmt.
| Lösung | c | pH | |
| (i) | Salzsäure | 0,1 mol · L−1 | |
| (ii) | Ethansäure | 0,1 mol · L−1 | |
| (iii) | Ethanol | 0,1 mol · L−1 |
Erklärungen
(i) Der pH-Wert entspricht einer H3O+-Konzentration von ungefähr 0,1 mol/L ( = c0(HCl)).
| HCl(aq) | + | H2O(l) | → | H3O+(aq) | + | Cl−(aq) | |
| c0 | 0,1 mol · L−1 | 10−7 mol · L−1 ≈ 0* | 0 mol · L−1 | ||||
| −x | +x | +x | |||||
| c | 0,1 mol · L−1 |
Die Auswertung ergibt für x 0,1 mol/L. Folglich ist die Protolyse vollständig. Alle HCl-Moleküle haben mit Wasser zu H3O+-Ionen (der stärksten im Wasser möglichen Säure, nivellierender Effekt des Wassers) und einem Rest-Ion reagiert.
Säuren die mit Wasser eine vollständige Protolyse eingehen werden als starke Säuren bezeichnet. |
(ii) Der pH-Wert entspricht einer H3O+Konzentration von ungefähr 0,001 mol/L ( << c0(CH3COOH)). Diese ist viel geringer als jene der Essigsäure.
| CH3COOH(aq) | + | H2O(l) | ⇌ | H3O+(aq) | + | CH3COO−(aq) | |
| c0 | 0,1 mol·L−1 | 10−7 mol·L−1 ≈ 0* | 0 mol·L−1 | ||||
| −x | +x | +x | |||||
| c | 0,001 mol·L−1 |
Die Auswertung ergibt für x ungefähr 0,001 mol·L−1. Folglich ist die Protolyse unvollständig. Nur ein Teil, etwa ein Hundertstel der Essigsäure-Moleküle, sind zu Acetat umgesetzt.
Säuren die mit Wasser eine unvollständige Protolyse eingehen, bei der sich ein Gleichgewicht einstellt, werden als schwache Säuren bezeichnet. |
(iii) Der pH-Wert entspricht einer H3O+-Konzentration von 10−7 mol/L (reines Wasser).
| CH3CH2OH(aq) | + | H2O(l) | H3O+(aq) | + | CH3CH2O−(aq) | ||
| c0 | 0,1 mol·L−1 | 10−7 mol·L−1 * | 0 mol·L−1 | ||||
| −x | +x | +x | |||||
| c | 10−7 mol·L−1 |
Die Konzentration an Oxonium-Ionen bleibt unverändert. Es findet keine Protolyse statt. Alkohol reagiert nicht als Säure mit Wasser.
Säuren, die mit Wasser keine Protolyse eingehen, werden als sehr schwache Säuren bezeichnet. Diese Stoffe werden in wässriger Lösung nicht als Säuren betrachtet. |